|
Molecular Stressors Engender Protein Connectivity Dysfunction through Aberrant N-Glycosylation of a Chaperone
Pengrong Yan, Hardik J. Patel, Sahil Sharma, Adriana Corben, Tai Wang, Palak Panchal, Chenghua Yang, Weilin Sun, Thais L. Araujo, Anna Rodina, Suhasini Joshi, Kenneth Robzyk, Srinivasa Gandu, Julie R. White, Elisa de Stanchina, Shanu Modi, Yelena Y. Janjigian, Elizabeth G. Hill, Bei Liu, Hediye Erdjument-Bromage, Thomas A. Neubert, Nanette L.S. Que, Zihai Li, Daniel T. Gewirth, Tony Taldone, and Gabriela Chiosis
Cell Reports 31(13), 107840, (June 30, 2020)
作者采用了多种实验技术来研究分子伴侣蛋白GRP94在压力诱导下N-糖基化引起的蛋白结构和功能变化。
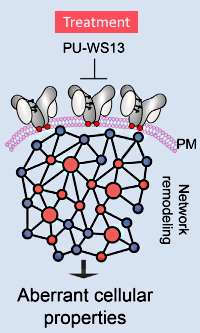
使用非变性以及SDS-PAGE,siRNA敲减,酶切去糖基化,CRISPR / Cas9介导的突变体和敲除,通过流式细胞仪进行细胞活性分析,PK / PD /毒理学研究以及使用LC-MS /MS鉴定N-糖基化位点,他们证明了N-糖基化将GRP94从折叠蛋白转变为支架蛋白。
这种N -糖基化的特异性增加促使蛋白质空间结构的改变,使之能够与质膜上癌蛋白持久相互作用。作者还表明,使用小分子嘌呤化合物可以选择性抑制这种异常形式的形成,预示了一种潜在的治疗方式。
|
 |